9. Respuestas ejercicios deber¶
A continuación se presentan algunos ejercicios sobre el tema de procesamiento de ficheros, regex y pipes aplicados a Bioinformática.
Nota: Para resolver estos ejercicios se necesita que hayan entenido de forma adecuada los temas de Introducción a Unix y GNU/Linux, Jupyter Lab, y Manejo terminal.
El primer paso para realizar los ejercicios será descargar el repositorio de GitHub del curso, que lo pueden encontrar en el siguiente link. Después, deben abrir una terminal y moverse a la carpeta en la que está el archivo del notebook, como se muestra a continuación:
cd ~/Downloads/unix.bioinfo.rsgecuador-gh-pages/Ejercicios_fines_de_semana/Curso_basico
Después, deben activar su ambiente de conda en el que instalaron Jupyter-Lab con kernel de Bash, e iniciar un servidor de Jupyter-Lab, como se muestra a continuación:
conda activate bash
jupyter-lab
Finalmente, deben abrir una celda del notebook y moverse al directorio _files con el comando cd, como se muestra a continuación:
cd ../../_files
Pueden verificar que están en la carpeta _files con el comando ls.
Nota: Para todos los ejercicios asumimos que están trabajando dentro del directorio _files, por lo que comprueben que est se cumpla siempre que corran un comando.
ls
1. Vamos a realizar una simulación de dinámica molécular de la proteína prM del virus del Dengue (PDB ID: 3c5x) para replicar las condiciones biológicas en las que esta proteína se encuentra y obtener una estructura estable. Para esto usaremos el archivo 3c5x.pdb que se encuentra en la carpeta _files dentro del directorio raíz del repositorio de GitHub
1.1. Los archivos del Protein Data Bank (PDB) tienen una nomenclatura por defecto para los aminoácidos. En esta nomenclatura, la cysteína se nombra como CYS. Sin embargo, en algunos programas de simulación como Amber la nomenclatura de los aminoácidos es diferente. Para que el programa pueda reconocer los aminoácidos de cisteína, estos se deben nombrar como CYX en lugar de CYS. Usando los conocimientos adquiridos en el curso, transformar el nombre de todos los aminoácidos de cisteína del archivo 3c5x.pdb de CYS a CYX y guardar el nuevo archivo como 3c5x_cyx.pdb en la carpeta _files.
sed 's/CYS/CYX/g' 3c5x.pdb > 3c5x_cyx.pdb
1.2. Las primeras 579 líneas del archivo 3c5x.pdb son informativas y no son parte de la secuencia que necesita el programa para realizar la simulación. Por tanto, queremos reemplazar el nombre CYX por CYS de las primeras 579 líneas del archivo 3c5x_cyx.pdb creado previamente, y guardar el nuevo archivo como 3c5x_cyx_cys.pdb en la carpeta _files.
sed '1,579 s/CYX/CYS/g' 3c5x_cyx.pdb > 3c5x_cyx_cys.pdb
1.3. Las primeras 579 líneas son solamente informativas y no influyen en la simulación de la proteína. Por tanto, queremos eliminar las líneas 4-579 del archivo 3c5x_cyx_cys.pdb y guardar el nuevo archivo como 3c5x_cyx_cys_clean.pdb en la carpeta _files.
sed '4,579d' 3c5x_cyx_cys.pdb > 3c5x_cyx_cys_clean.pdb
1.4. Además de la información de los aminoácidos de las proteínas, los archivos PDB suelen tener información sobre átomos especiales como metales o puentes de hidrógeno, que se identifican con el código HETATM al inicio de las líneas. Supongamos que en nuestra simulación no nos interesan estos átomos y queremos eliminarlos del archivo 3c5x_cyx_cys_clean.pdb y guardar el nuevo archivo como 3c5x_no_HETATM.pdb en la carpeta _files.
# Primero buscamos las líneas que poseen el código HETATM
grep -E -n "^HETATM" 3c5x_cyx_cys_clean.pdb
# Ahora eliminamos estas líneas
sed '3693,3776d' 3c5x_cyx_cys_clean.pdb > 3c5x_no_HETATM.pdb
1.5. Otros datos que se muestran en los archivos PDB son los puentes disulfuro entre átomos S de los aminoácidos de cisteína, que se identifican con el código CONECT al inicio de las líneas. Supongamos que también queremos eliminar esta información del archivo 3c5x_no_HETATM.pdb y guardar el nuevo archivo como 3c5x_no_HETATM_CONN.pdb en la carpeta _files.
# Primero buscamos las líneas que poseen el código CONECT
grep -E -n "^CONECT" 3c5x_no_HETATM.pdb
# Ahora eliminamos estas líneas
sed '3693,3710d' 3c5x_no_HETATM.pdb > 3c5x_no_HETATM_CONN.pdb
1.6. Los archivos PDB suelen tener más de una cadena en su estructura proteica. Para establecer el fin de una cadena y el inicio de otra, en estos archivos se usa el código TER. Busca el número de línea en el que finaliza la cadena A y empieza la cadena C del del archivo 3c5x_no_HETATM_CONN.pdb.
# Opción 1
grep -n "TER" 3c5x_no_HETATM_CONN.pdb
1.7. Ahora que conocemos el número de línea en la que termina la cadena A y empieza la cadena C del archivo 3c5x_no_HETATM_CONN.pdb, queremos separar las dos cadenas y colocar su información en dos archivos diferentes llamados 3c5x_cadA.pdb y 3c5x_cadB.pdb en la carpeta _files.
# Opción 1 sed
# Cadena A
sed -n '1,3051p' 3c5x_no_HETATM_CONN.pdb > 3c5x_cadA.pdb
# Cadena B
sed -n '3052,3692p' 3c5x_no_HETATM_CONN.pdb> 3c5x_cadC.pdb
# Opción 2 sed
# Cadena A
sed '3052,3692d' 3c5x_cyx_clean.pdb > 3c5x_cadA.pdb
# Cadena B
sed '1,3051d' 3c5x_cyx_clean.pdb > 3c5x_cadC.pdb
# Opción 3 split
split -l 3051 3c5x.pdb
1.8. Intenta juntar los comandos de los ejercicios 1.1 a 1.5 usando piping y aplica esta secuencia de comandos al archivo 3c5x.pdb. Guarda el archivo final en un fichero llamado 3c5x_procesado.pdb en la carpeta _files. Usa el comando diff para verificar que los archivos 3c5x_procesado.pdb y 3c5x_no_HETATM_CONN.pdb son iguales.
sed 's/CYS/CYX/g' 3c5x.pdb | sed '1,579 s/CYX/CYS/g' | sed '4,579d' | sed '3693,3776d' | sed '3693,3710d' > 3 c5x_procesado.pdb
diff 3c5x_no_HETATM_CONN.pdb 3c5x_procesado.pdb
2. En este ejercicio se obtendrá información de un archivo fasta, que contiene la secuencia de nucleótidos de un gen de un microorganismo. Para esto usaremos el archivo secuencia1.fasta que se encuentra en la carpeta _files dentro del directorio raíz del repositorio de GitHub
2.1. En las secuencias de ADN se encuentran varios motivos (secuencias pequeñas muy conservadas) como los que dan inicio y término a los procesos de replicación, transcripción y traducción. La señal para el inicio de la transcripción es dada por la presencia de la TATA box (TATAAA o TATAAT) y la señal para el término de la transcripción es la presencia de varias Adeninas (5 o más), con lo que se obtiene un transcrito (ARN mensajero). Determinar el número de señales de inicio y de terminación del archivo secuencia1.fasta y establecer si hay igual número de señales de inicio y terminación.
# Opción 1
# Señales de inicio
grep -E -c "TATAAA|TATAAT" secuencia1.fasta
# Señales de terminación
grep -E -c "A{5,}" secuencia1.fasta
# Opción 2
# Señales de inicio
grep -E "TATAAA|TATAAT" secuencia1.fasta | wc -l
# Señales de terminación
grep -E "A{5,}" secuencia1.fasta | wc -l
2.2. Otros motivos importantes son los de unión para factores de transcripción (FT). Se conoce que un FT se puede unir específicamente a los motivos ATXXTC, ACAXTT, o TTTCXXA en donde la X puede corresponder a cualquier nucleótido. Determine si la secuencia del archivo secuencia1.fasta posee motivos de unión a FTs, y en caso de tenerlos cuántos de estos motivos posee.
Nota: Considera que en una misma línea puede haber más de una coincidencia.
# Opción 1
grep -E -o "AT..TC|ACA.TT|TTC..A" secuencia1.fasta | wc
2.3. Determinar la o las sub-secuencias del archivo secuencia1.fasta que empiezan con el motivo TACA y terminan con AAAAAT.
Nota: Las sub-secuencias pueden estar en cualquier parte del texto, no necesariamente al inicio de la línea.
grep -E "TACA.+AAAAAT" secuencia1.fasta
2.4. Determinar si la secuencia del archivo secuencia1.fasta termina con el motivo TATACAATGA
grep -E "TATACAATGA$" secuencia1.fasta
3. En este ejercicio se obtendrá información de un archivo multifasta, compuestos por varias secuencias de nucleótidos, en el que cada secuencia es un genoma completo de diferentes cepas o muestras de Sulcia muelleri (un endosimbionte de insectos). Para esto usaremos el archivo sul_genomas.fasta que se encuentra en la carpeta _files dentro del directorio raíz del repositorio de GitHub
3.1. Se debe considerar que en un archivo multifasta cada secuencia posee un header que empieza con el caracter >. Determinar cuántos genomas en total se encuentran en el archivo sul_genomas.fasta
# Opción 1
grep -E -c ">" sul_genomas.fasta
# Opción 2
grep ">" sul_genomas.fasta | wc -l
3.2. Se desea identificar los códigos de todas las secuencias del archivo sul_genomas.fasta, que se encuentran en los headers junto al caracter > (por ejemplo CP006060.1), y exportar estos códigos a un nuevo archivo llamado codigos_sul_genomas.txt en la carpeta _files. Se deben eliminar los caracteres > en el archivo de salida.
# Opción 1
grep -E -o "^>[A-Z]{1,2}_?[A-Z0-9]{1,8}\.[0-9]" sul_genomas.fasta | sed -r 's/>/ /g' > codigos_sul_genomas.txt
# Opción 2
grep -E ">" sul_genomas.fasta | cut -f1 -d ' ' | sed -r 's/>/ /g' > sul_genomas_codigos.txt
3.3. Se desea identificar el nombre completo de las cepas o muestras de todas las secuencias del archivo sul_genomas.fasta y exportar estos códigos a un nuevo archivo llamado nombres_sul_genomas.txt en la carpeta _files. Por ejemplo, el nombre completo de una de las secuncias sería: Candidatus Sulcia muelleri isolate SMAURBIH.
grep -E -o "(Candidatus Sulcia muelleri|Blattabacterium cuenoti)( str.| strain| | isolate) ?[A-Za-z-]{2,10}" sul_genomas.fasta > nombres_sul_genomas.txt
3.4 Se desea buscar la secuencia TTTATTCCTAAAATAAAAGAAGATGAA en el genoma de Candidatus Sulcia muelleri CARI del archivo sul_genomas.fasta.
grep -n ">" sul_genomas.fasta
sed -n '5446,8903p' sul_genomas.fasta | grep -n "TTTATTCCTAAAATAAAAGAAGATGAA"
4. En este ejercicio se obtendrá información de un archivo multifasta, compuestos por varias secuencias de proteínas, en el que cada secuencia es una proteína de la bacteria Streptomyces calvuligerus. Para esto usaremos el archivo S_clavuligerus_proteome.fasta que se encuentra en la carpeta _files dentro del directorio raíz del repositorio de GitHub
4.1. Determinar cuántas proteínas posee el proteoma de Streptomyces calvuligerus en base al archivo S_clavuligerus_proteome.fasta
# Opción 1
grep -E -c ">" S_clavuligerus_proteome.fasta
# Opción 2
grep -E ">" S_clavuligerus_proteome.fasta | wc -l
cd ../../_files
4.2. Listar los headers de las secuencias de todas las proteínas y colocar esta información en una archivo llamado headers_S_clavuligerus_proteome.txt en la carpeta _files.
grep -E ">" S_clavuligerus_proteome.fasta > headers_S_clavuligerus_proteome.txt
cat headers_S_clavuligerus_proteome.txt
4.3. Obtener solamente el código Uniprot (que está entre | |, por ejemplo B5H048) de los headers de todas las secuencias de proteínas y añadir esta información en un archivo llamado codigosUniptot_S_clavuligerus_proteome.txt en la carpeta _files. Para realizar esto se puede tomar como input el archivo generado en el anterior literal.
# Opción 1
grep -E -o "\|[A-Za-z0-9]{1,6}\|" headers_S_clavuligerus_proteome.txt | sed -r 's/\|/ /g' > codigosUniptot_S_clavuligerus_proteome.txt
# Opción 2
cut -d '|' -f2 headers_S_clavuligerus_proteome.txt > codigosUniptot_S_clavuligerus_proteome.txt
4.4. Obtener solamente el nombre de los organismos (caracteres que están luego de OS=) de los headers de todas las secuencias de proteínas y añadir esta información en un archivo llamado organismos_S_clavuligerus_proteome.txt en la carpeta _files. Para realizar esto se puede tomar como input el archivo del literal 1.3.
Nota: En este caso todos los nombres serán los mismos, pero en archivos fasta con información de varios organismos sería muy útil.
# Opción 1
grep -E -o "OS=[A-Z a-z]+" headers_S_clavuligerus_proteome.txt | sed -r 's/OS=/ /g' > organismos_S_clavuligerus_proteome.txt
# Opción 2
cut -d'=' -f2 headers_S_clavuligerus_proteome.txt | grep -E -o "[A-Z a-z]+ \(" | sed -r 's/\(/ /g' > Organismos_S_clavuligerus_proteome.txt
4.5. Obtener solamente el nombre de las proteínas (caracteres antes de OS=) de los headers de todas las secuencias de proteínas y añadir esta información en un archivo llamado proteinas_S_clavuligerus_proteome.txt en la carpeta _files. Para realizar esto se puede tomar como input el archivo generado en el literal 1.3.
# Opción 1
grep -P -o "\|[A-Z0-9]{1,6}_[A-Z0-9]{1,5}[A-Za-z0-9 \[\]()+,.'/:_\-]+ OS" headers_S_clavuligerus_proteome.txt | sed -r 's/\|[A-Z0-9]{1,6}_[A-Z0-9]{1,5}/ /g' | sed -r 's/OS/ /g' > proteinas_S_clavuligerus_proteome.txt
4.6. Separar los headers y las secuencias de aminoácidos de las proteínas que tienen los siguientes códigos: B5GNS8, B5H296, B5GRF2 y B5GTR3 (para esto debes usar el archivo fasta inicial: S_clavuligerus_proteome.fasta). Colocar esta información en un archivo llamado 4seq_S_clavuligerus_proteome.fasta en la carpeta _files.
grep -E -A10 -n -e 'B5GNS8' -e 'B5H296' -e 'B5GRF2' -e 'B5GTR3' S_clavuligerus_proteome.fasta
sed -n '12114,12118p' S_clavuligerus_proteome.fasta > 4seq_S_clavuligerus_proteome.fasta
sed -n '27251,27256p' S_clavuligerus_proteome.fasta >> 4seq_S_clavuligerus_proteome.fasta
sed -n '27310,27317p' S_clavuligerus_proteome.fasta >> 4seq_S_clavuligerus_proteome.fasta
sed -n '40706,40712p' S_clavuligerus_proteome.fasta >> 4seq_S_clavuligerus_proteome.fasta
4.7. Determinar si en la secuencia de la proteína con código Uniprot B5H296 existe un aminoácido de serina (S), seguido de una prolina (P), con tres alaninas (A) en medio de los dos aminoácidos (S y P). El patrón a buscar sería SAAAP. Puedes usar la información de la ubicación de la secuencia obtenida en el anterior literal.
sed -n '27251,27256p' S_clavuligerus_proteome.fasta | grep -E -n "SA{3}P"
5. En este ejercicio se obtendrá información de archivos fastq, que cotienen secuencias de nucleótidos y la calidad de su proceso de secuenciación. Para esto usaremos los archivos secuencias1.fastq, secuencias2.fastq y secuencias3.fastq que se encuentra en la carpeta _files dentro del directorio raíz del repositorio de GitHub
5.1. La letra N representa un nucleótido que no pudo ser leído correctamente, y se reporta como ninguno, o missing data. Imprime el número de secuencias que tenga diez N seguidas por cada uno de los archivos fastq de la carpeta _files.
Nota: Es posible realizar esto con un comando de una sola líne, intenta resolverlo de esta forma.
grep -E -c "NNNNNNNNNN" *.fastq
5.2. Ahora, determina el número de secuencias de cada archivo .fastq por separado. Se conoce que los títulos de las corridas de las secuencias en cada archivo .fastq empiezan con el string @SRR098026.
grep -E -c '^@SRR098026' *.fastq
5.3. Pero esta información está muy desordenada. No sabemos a qué corrida le petenece esta secuencia (identificador) ni la calidad de la secuencia con diez N seguidas. Entonces, podríamos incluir las 4 líneas de cada corrida. ¿Cómo incluirías las 4 lineas de información de cada corrida que contenga la secuencia NNNNNNNNNN del archivo secuencias1.fastq?
grep -A2 -B1 "NNNNNNNNNN" secuencias1.fastq
5.4. Pero esta información nos podría servir mucho más si está en un archivo fastq y no solo en la pantalla del jupyter notebook o de la terminal. Qué tal si exportamos la información de todas las secuencias que contienen diez N seguidas, de todos los archivos .fastq, a un archivo llamado malas_lecturas.fastq en la carpeta _files.
grep -A2 -B1 "NNNNNNNNNN" *.fastq > malas_lecturas.fastq
5.5. ¿Cuántas líneas de las secuencias de cada uno de los tres archivos fastq contienen el motivo ACG?
grep -E -c "ACG" *.fastq
5.6. Ahora, coloca las anteriores secuencias que contienen ACG en el archivo malas_lecturas.fastq sin sobre escribir el archivo. Luego imprime las últimas 40 líneas del archivo malas_lecturas.fastq.
grep "ACG" *.fastq >> malas_lecturas.fastq
tail -n 40 malas_lecturas.fastq
5.7. Ahora vamos a buscar patrones en el archivo malas_lecturas.fastq. Antes creamos un archivo llamadopatrones.txt, donde imprimirás estos motivos ACTG, CCCCC, NNNCNNN, NNNGNNN, TTTT, TATA, AAA. Luego, usa este archivo para buscar estos patrones en el arcvhio malas_lecturas.fastq.
echo -e 'ACTG\nCCCCC\nNNNCNNN\nNNNGNNN\nTTTT\nTATA\nAAA' > patrones.txt
grep -f patrones.txt malas_lecturas.fastq
5.8. Tomando el archivo acg.txt, convierte los fragmentos ACG en secuencias de ARN. Recuerda que se puede hacer eso cambiando las timinas por uracilos (Reemplzar T por U).5.8. Tomando el archivo acg.txt, convierte los fragmentos ACG en secuencias de ARN. Recuerda que se puede hacer eso cambiando las timinas por uracilos (Reemplzar T por U).
#sed -i '' -e 's/T/U/' acg.txt # macOS
sed -i -e 's/T/U/' acg.txt # Linux
6. En este ejercicio se obtendrá información de un archivo obtenido de un experimento de microarray, en el que se calcula la expresión génica de una muestra. Para esto usaremos el archivo microarray.txt que se encuentra en la carpeta _files dentro del directorio raíz del repositorio de GitHub
6.1. Determinar el número genes relacionados con la leucemia (en el documento se encuentra como leukemia). En este caso esto se determinará por la presencia del nombre de la enfermedad en los nombres de los genes.
# Opción 1
grep -E -c 'leukemia' microarray.txt
# Opción 2
grep -E 'leukemia' microarray.txt | wc
6.2. De todo el registro, solo queremos el nombre y la descripción de los genes relacionados con leucemia (campos/columnas 3 y 4 del archivo), lo que se desea copiar a un archivo llamado genes_leucemia.txt en la carpeta _files.
# Usando comandos como grep, set, cut, etc
grep 'leukemia' microarray.txt | cut -f3,4 > genes_leucemia.txt
6.3. Se desea eliminar las comillas de los nombres y descripción de los genes relacionados con leucemia, obtenidos en el archivo del literal anterior, y guardar los cambios en el mismo archivo genes_leucemia.txt.
# Usando comandos como grep, set, cut, etc
sed -i 's/\"//g' genes_leucemia.txt
6.4. Ahora, se desea ordenar alfabéticamente los genes del archivo genes_leucemia.txt y eliminar los genes repetidos. Con estos cambios, guardar el resultado en un archivo llamado genes_leucemia_ord_uniq.txt
sort -u genes_leucemia.txt > genes_leucemia_ord_uniq.txt
6.5. Finalmente, se desea dterminar el número de genes que estaban repetidos
# Los repetidos serían la diferencia de ambos números
wc -l genes_leucemia.txt
sort -u genes_leucemia.txt | wc -l
7. En este ejercicio se buscarán sitios d reconocimiento de enzimas de restricción en secuencias ITS de hongos. Para esto usaremos los archivos .fasta de la carpeta ITS_region que se encuentra en la carpeta _files dentro del directorio raíz del repositorio de GitHub
Para este ejercicio se debe conocer lo que es un mapa de restricción, que es un gráfico en el que se representan los sitios en los que diferentes enzimas de restricción poseen dianas en una molécula particular de ADN
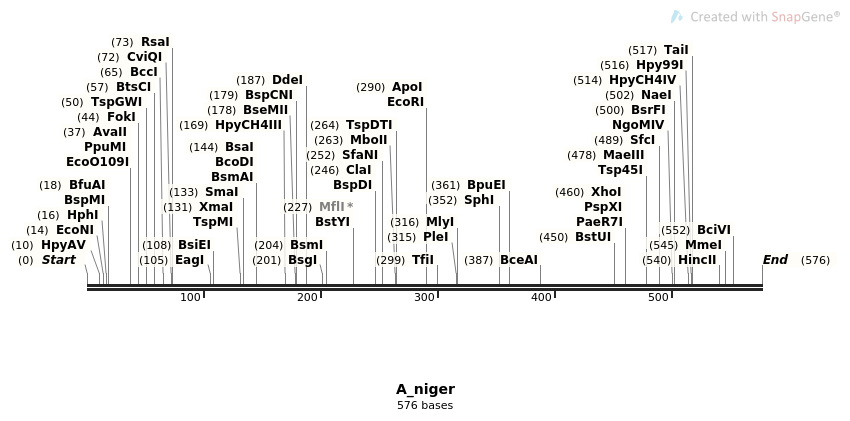
En este ejemplo se seleccionaron las siguientes enzimas de restricción:
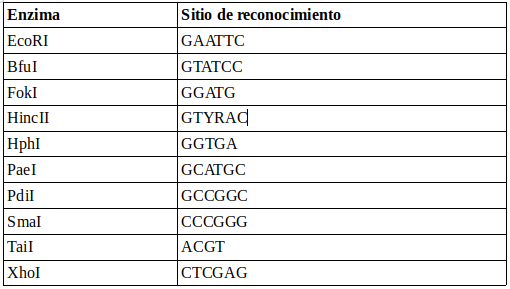
En los siguientes ejercicios se buscarán los sitios de reconocimiento de estas enzimas en la región ITS de diferentes especies de hongos.
7.1. Determinar qué archivo(s) poseen la secuencia de reconocimiento de la enzima EcoRI y cuántas de estas secuencias existen en cada uno de los archivos.
grep -c "GAATTC" ITS_region/*.fasta
7.2. Determinar qué archivo posee doble o triple secuencia de reconocimiento de las enzimas SmaI y TaiI.
grep -c "CCCGGG" ITS_region/*.fasta
grep -c "ACGT" ITS_region/*.fasta
7.3. Especificar el número de la línea donde hubo la o las coincidencias del sitio de reconocimiento de la enzima TaiI del archivo T_delbrueckii.fasta
grep -n "ACGT" ITS_region/T_delbrueckii.fasta
7.4. La enzima HincII presenta una secuencia de reconocimiento “degenerada”, en la que la letra Y puede ser los nucleótidos C o T y la letra R puede ser G o A. Buscar la cantidad de estas secuencias en todos los archivos .fasta de las secuencias ITS.
# Opción 1
grep -E -c "GTCAAC|GTCGAC|GTTAAC|GTTGAC" ITS_region/*.fasta
# Opción 2
grep -E -c "GT[CT][AG]AC" ITS_region/*.fasta
# Esto se puede verificar mediante la etiqueta -o de egrep
grep -E -o "GTCAAC|GTCGAC|GTTAAC|GTTGAC" ITS_region/*.fasta
7.5. Buscar las 10 lineas posteriores y 10 anteriores donde hubo la coincidencia de la enzima EcoRI de todas las secuencias .fasta y almcacenar los resultados en un archivo llamado sitios_rec_EcoRI.fasta. Intenta evitar imprimir el nombre del archivo del que provienen las secuencias.
grep -B10 -A10 -h "GAATTC" ITS_region/*.fasta > sitios_rec_EcoRI.fasta
7.6. Verifica si la secuencia del archivo secuencia.txt está presente en el archivo secuencias.txt.
grep -f ITS_region/secuencia.txt ITS_region/secuencias.fasta
7.7. Utiliza la información del archivo sites.txt para buscar si estos sitios de restricción estań presentes en los archivos fasta de la carpeta ITS_region y cuántos existen.
grep -c -f ITS_region/sites.txt ITS_region/*.fasta
7.8. Utilizar la información del archivo sites.txt para buscar todos los sitios de restricción únicos presentes en los archivos fasta de la carpeta ITS_region
grep -h -o -f ITS_region/sites.txt ITS_region/*.fasta | sort -u
